資料11-測定手技 Measurement Method
1. 正確な結果を得るために
(1) はじめに
正確な結果を得るための測定手技について、5つの項目に分けて、特にその考え方を説明します。 具体的な実施方法については、3-B測定手技で説明します。
A-1検体の調製
検体(試料)自体が変動すると、機器や試薬が如何に正確に調製されても正しい結果は得られません。
検体の調製は結果に与える影響が大きく、正確な調製が求められます。検体を正確に調製するための例として、
以下の点が挙げられます。
まず、正確な採血することです。つまり、針を刺した時に無用に組織を傷つけ、あるいは採血している時に
針口面が血管に密着するなどのことが発生すると、血管内皮細胞からTF(組織因子)が放出され、凝固活性を
亢進し、短めの凝固時間を示すことになります。よって、なるべく血管を傷つけないように採血することが正確
な結果を出す為の第一条件となります。また、採血に使う器具でガラス製品を使用する場合は必ずシリコン処理
したものを使用する必要があります。ガラスに血漿が接触すると、ガラス表面のマイナス荷電のために凝固亢進
を招きます。経時的変化に留意しておかなくてはなりません。
次に、抗凝固剤(クエン酸ナトリウム)と血液とが正しく混合されたものであることが必要です。真空採血
管を使用する場合、通常は1:9に混合されますが、真空度が不良であったり、十分に採血される前に中断した
ような場合にはこの1:9のバランスが崩れ、クエン酸ナトリウムが相対的に多く含まれる血漿ができることに
なります。クエン酸ナトリウムは凝固試薬に含まれるカルシウムと拮抗する物質ですから、試薬中のカルシウム
濃度が一定の場合には凝固時間は延長傾向を示すことになります。
また、血漿の遠心分離を十分に行ない、血小板の混入がないようにすることも必要です。血小板の混入は
PTやAPTTの測定では特に問題はありませんが、他の測定項目分では、血小板が混入すると、PF3(血小
板第3因子=リン脂質)の混入のために正しい結果とならない場合があります。
採血後は速やかに測定することが重要ですが、測定できない場合には良好な条件下で保存しておくことが
必要です。液体のまま保存する場合には冷蔵庫などの出し入れにより温度変化を与えないように心掛けると共に、
炭酸ガスが放出しないよう密栓して置くことが必要です。検体の劣化は凝固時間の延長、検体pHの上昇
(pH8.6くらいまで)は凝固活性の短縮・その後劣化による延長を引き起こします。また、凍結する場合には、
採血後速やかに凍結し、できれば-70℃以下で保存します。保存中は冷凍庫の開閉により温度が変化する場合が
あるので、速やかに作業を済ませるようにします。
A-2試薬の準備
試薬は適正な条件下で保存されたものを使用すべきです。通常は直射日光を避け、冷暗所保存します。保存
条件外の凍結・融解処理をしたもの、あるいは有効期限外のもは使用してはいけません。
使用に際しては、計画性を持って、必要なものを必要なだけ準備します。溶解の前には室温に戻し、正確な
溶解・正確な定量に心掛けるようにします。また、試薬間の接触・コンタミに留意し、細菌汚染のないように処置
することが必要です。
A-3測定準備
測定に際しては、検体数量を確認に、また測定に必要な試薬量が準備されているかを確認します。検体はそれ
自体がClotしていないか、遠心分離が十分であるか、溶血などの現象がないかを確認し、もしそれらがあった
場合にはどの測定項目に影響があるか、をあらかじめ予想して置きましょう。その上で機器の測定設定(項目の確
認・設置場所の確認)を行ないます。また、測定結果をどのような計算をさせるのか、レポート(検査結果の報告)
内容と整合性が取れているかを調べます。また、緊急性のある検体であるか、通常の測定作業として処理して良い
ものであるかの確認も必要です。
一方、これらは作業のし易い場所で、自ら配置を考えて実施するようにしましょう。配置の如何で作業の正確性
・能率は大きく異なります。また、作業場所の清潔性にも配慮しましょう。
A-4正確度の確認
機器設置時に自施設のデータの正確性の程度を把握して置きます。正常域では凝固時間は何秒程度の上下変動
があり、異常域ではどのような傾向を示すのか、またそれらが精度管理等のデータにどのように表われ、許容でき
る範囲を設定して置きます。検査当日の精度管理等の結果が許容できるものであれば、この時点で始めて測定に着
手できると考えます。
上記の条件に照らし合わせて、当日の検査結果に検体のデータに誤りはないか?、ミスなどが発生していないか?
…をチェックします。さらに検体や試薬の経時変化を起こしていないか、また、検体の特性(採血の状態・共存
物質の有無、あるいは治療・投薬の有無・過去のデータ)によって影響を受けた結果となっていないか?、などを
確認し、検査結果が妥当なものであるかどうかを判断します。必要であれば、二次検査・精密検査を実行します。
A-5結果の報告
検査の依頼に対して、必要な検査が正確に行なわれているかを確認します。記載ミスがあってはならないことは
当たり前です。可能であれば、検査成績に対し、極力コメントを付けるようにします。
一方、検査を振り返り、検査が計画的に実施できたか、最小限のコストでできたか、また迅速且つ適正であった
か、…などを検証してみることも必要です。改良点があれば、着手できるところから改良し、計画的に変更しなけれ
ばならない箇所は検査室全体で話し合って改良するようにしましょう。
また、検査終了後は後片付けをきちんと行ないます。検査室を「きれい」にする、また、「きれい」に保つこと
は感染等から自身の安全性を確保する点でも、検査の正確性を向上させる点でも重要です。検査室を「きれい」な
状態にすることも忘れてはならない重要な点です。
設問(15):凍結乾燥試薬は冷蔵のまま、冷水で溶かす方が良い、か?
Yes or No
設問(16):可能な限り、測定データを検査前に予測しておくことは重要である、か?
Yes or No
設問(17):検査結果にはコメントを付けてはならない、か?
Yes or No
B.測定手技
測定手技
凝固検査は、①検体、②機器(または手技)、③試薬、の、「たった3つの要素」で実行されますが、得られる 結果は個人差が大きく且つ不安定です。しかし、これらの要素の変動を最小に抑えることにより、凝固試験成績を安 定化することができますし、問題が発生した場合にはたった3つの要素しかないのですから、一つ一つの側面からア プローチしていけば解決はたやすくなります。
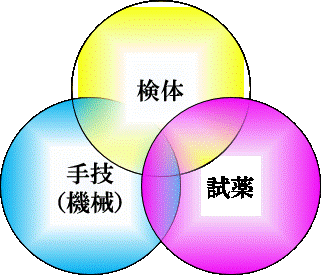
準備
①試験に使用する器具は清浄なものを使用する。
②ガラス器具の使用は避ける。使用する場合でも短時間に終了するようにする。
またシリコン処理していない器具は使用しない。
③定量器具(ピペット)はエッペンドルフピペットを薦める。
ホールピペットはトロンビン汚染の可能性が高く、且つ、操作性が良くない。
④トロンビンに接触した器具を他の測定と混同してはならない。トロンビンと
接触した可能性のある器具は廃棄する。
2. 採血
①まず、採血時に組織トロンボプラスチンの混入がないよう慎重に採取されなけれ
ばなりません。組織因子が混入すると外因系が活性化し、凝固時間が短くなります。
②この時、抗凝固剤は一定の濃度のもの(3.2%or3.8%クエン酸ナトリウム)を使用
し、正確に1:9容となるよう採取します。変動の目安としては±8%。
③採血管はシリコンコートしたガラス製試験管または樹脂製試験管を使用することが
必要です。ガラスのままでは接触因子系が活性化し、凝固活性が亢進します。市販
の採血管を使用していてもシリコン処理が充分でないことがあり、採血したまま放
置して置くと凝固する場合がありますので注意が必要です。
④採血後においては、速やかに遠心分離し、直ちに測定に供します。遠心分離は3000
rpm×10~15分間、または、3500rpm×10分間。PPPが得られれば特に問題
ありません。遠心分離後はなるべくフタをとらずに置きましょう。
炭酸ガスが蒸発してpH上昇の原因となります。
⑤検体(血漿)は採血後は経時的に変化するものとして扱い、直ちに測定します。
測定までの目安は2時間以内です。
直ちに測定ができない場合はフタをしたまま冷蔵保存します。
⑥測定に際しては血小板の混入がないよ配慮すること、また、検体同士のコンタミに
留意し、測定に供する採取量は正確に定量することが必要です。
B-2 検体の凍結・融解
凍結検体の保存&溶解
①検体血漿を凍結する際は、採血後の時間の経過していないものを凍結に使用する。
時間が経過したものは劣化が進み、凍結処理により一段と劣化するため、凍結前・
後のデータが乖離する場合がある。
②検体の凍結は-70℃以下でおこなう。-20℃では劣化する。また冷凍庫の開閉
により、劣化する場合があるので、注意を要する。
④凍結時に発泡スチロールなどで覆われたものは冷却能力が悪い。これにより検体の
劣化を招くので、熱が分散しやすい包装で凍結する。
⑤凍結回数は新鮮なものでも3回が限界である。4ヶ月以上の保管は避ける。
⑥凍結に際しては、日時・検体番号・検体の特徴・保管者・液量などを明記する。
⑦凍結中に扉を開けっ放して検体に温度変化を起こさせないように配慮する。
⑧融解に際しては37℃水槽で速やかに溶かす。
⑨氷は80~90%溶けたら、水槽より取り出し、転倒撹拌して残りの氷を溶かす。
加温のし過ぎは検体の劣化を招く。
⑩融解した検体は1時間以内に測定が終了するよう試験計画を立てる。
コントロール血漿(凍結乾燥)の溶解
①試薬を溶解する作業の前に実施する。
試薬溶解よりも後になった場合には、場所を変え、清浄な箇所でおこなう。
②溶解液はその度新しいものを準備する。
③ゴム栓をゆっくりとはずし、ゆるやかに溶解液を入れる。
入れたらゆっくりと回転させ、約3分間静置する。
その後、撹拌して完全に溶解させる。この時、残存物がないか、必ずチェックする。
④室温に静置し、使用を待つ。加温加冷はしない。
3. 試薬の溶解
凍結乾燥試薬の溶解
試薬は、指示の通り適正に準備し、且つ、使用方法・保存方法を守って使用されな
ければなりません。そのため、まず、以下の点を確認してください。
①まず、納入された試薬は保存温度を厳守して納品されたものであること。
②納入後は適正な温度で保存されていること。
冷蔵庫や冷凍庫の扉の開閉により、温度の変化がないように注意する必要があり
ます。特に温度の低い冷凍庫では室温との差が100℃以上ある場合があり、また
開けっ放しにしておくと結露の原因となりますから、開閉は速やかにするよう
習慣化しましょう。日頃、整理・整頓しておくことも重要です。
次に試薬溶解に際して、以下の点に留意して取り扱ってください。
①試薬溶解に際しては、まず、室温に戻します。凝固で使用される試薬は生物製
剤ですから、温度差のある溶解液を直ちに注ぐのではなく、充分な時間をかけ
て室温に戻します。
②溶解に際しては、凝固活性能の低い試薬から順番に溶解するように順番を決め
ます。例えば、トロンボテストやヘパプラスチンテスト試薬を先に溶解し、トロン
ビン試薬は最後にし、しかも、他の試薬にコンタミしないよう離れた場所で溶解
します。特にトロンビン試薬は凝固能に与える影響が大きいので、試薬溶解に用
いた器具や容器は別々にし、混同しないようにする必要があります。デイスポー
サブル器具の使用をお奨めします。
③溶解液を準備する。溶解液は室温、または37℃のもの用意する。
④試薬のフタを空け、溶解液を注ぐ。試薬びんのフタは乾燥物が飛び散らないよう
に注意深く空ける。乾燥物が飛散し易い場合はびんのフタを空けず、重量を測定
し、ゴム栓を付けたままで、少量の溶解液を入れた注射器の針を差し、溶解させ
る。その後、重量を測定しながら規定量の溶解液で溶解する。
フタを空けて溶解させる場合は粉末が飛び散らないようゆっくりと丁寧にフタを
開け、ゆるやかにピペットで溶解液を入れる。溶解液は激しく注がず、壁面を伝
わる程度に注ぎます。このとき、泡のたたないように留意する。また、ピペット
の先端と試薬びんとが接触すると、他の試薬あるいは血漿へのコンタミネーショ
ンの原因となりますから、絶対に接触させないように注意が必要です。管壁にピ
ペットの先端が接触した場合は、器具は廃棄する。
また、試薬コンタミの原因となるので、試薬溶解に使用した水は混同して使用し
てはならない。(特に、血漿溶解に使用してはならない。)
⑤液を入れたら、直ちに、ゆっくりと2~3回回転させて、溶解の状況を確かめます。
この時、激しく振らないようにします。蛋白製剤ですから絶対に泡を立てないよ
うします。この後、使用説明書に記載された時間(約10分間~30分間)静置する。
⑥溶解したら、使用前に再度撹拌します。前回よりやや激しく撹拌して、充分に混
合します。
⑦トロンビン試薬は他の試薬に影響を与え易いので、溶解は最後におこなう。
⑧測定に際しては、正確に分注することが必要です。
⑨用手法において(加温が必要な場合)は、検体(血漿)と試薬が混合される直前
までに適正な温度となっていなければ異なる結果となります。また、加温も過ぎ
ると悪影響を与えますから、加温を始めてから適正な温度になったら直ぐに使用
するようにしましょう。
試薬の保存
①取り扱い説明書に従って、保存する。
②生物製剤で加熱(または凍結)したものは原則的には使用不可である。
③試薬同士のコンタミがないよう留意する。特に、ゴム栓を間違えないよう注意する。
④トロンビン試薬は他の試薬に影響を与え易いので、取り扱いは最後にする。
また、トロンビン試薬を触った手で他の試薬や血漿を触らないこと。
どうしても触らなければならない場合は、一度、手を洗ってから作業をおこなう。
⑤可能な限り冷所(4℃)保存する。
4.その他
測定機
測定機器は今日多様の測定原理に基づく機器が出回っており、表示される結果もまちま
ちです。しかし反応中の温度を正確に37℃に保持して凝固反応をおこなわせることは
最低限の性能と言えます。検出法としては、基本的には用手法を起点として、それぞれ
の機器の正確度を判定して置く必要があります。ただ、機器により撹拌力が異なるので
凝固測定においては重大な結果の誤差要因となります。このことは用手法においても同
様です。
その他
①作業の片付け、整理整頓、実験室の清浄化に関しては充分おこなう。
そうでないと次回実験でデータ不良の原因となる。
②試薬間/検体間の汚染を避けるため、可能な限り、デスポの使用を心がける。
③器具は専用化する。
設問(18):トロンビン試薬が混入してもデータに影響はないので、最初に溶かしても良い、か?
Yes or No
設問(19):凝固試薬では細菌汚染を気にすることは必要ない、か?
Yes or No
C.異常の発見
C-1異常の発見
データ異常が見つかった場合、まず、凝固時間、次に凝固曲線を調べます。凝固時間は
短縮か、あるいは延長であるかの情報が判ります。凝固曲線の情報からは、特にΔHが
正常に得られているか、曲線そのものに異常がないかを調べてください。それらの結果
から、異常の原因が、①検体であるのか、②試薬であるのか、③機器であるのか、を推
定します。通常は原因は一つであり、複合的に異常が発生することはありませんので、
如何なる手法を使っても一つに原因を絞り込むことが重要です。
(1)検体の場合
短縮傾向の結果となる場合には、以下の2点が主要な原因となります。
①トロンビン等の試薬が検体にコンタミしたためによるもの
②採血ミス、あるいは採血管不良(抗凝固剤の不良や、シリコン処理の不良)
延長傾向の結果となる場合には、多様な原因が考えられますので、例えば次の点を
確認し、対応を図ります。
1) 薬剤の投与により、データ異常を引き起こしていないか?
2) 採血ミス、あるいは採血管不良を起こしていないか?(クエン酸Naが多い)
3) 経時変化、保存条件の不良(COガスが抜け、pHが高くなっている)
4) Clotを発生していないか?
5) 検体のコンタミ、検体の取り違えや血清検体を使用していないか?
6) 特異的な検体であるか、
7) 他の検体、あるいは他の項目測定結果との比較
(2)試薬の場合
短縮傾向の結果となる場合には、以下の2点が主要な原因となります。
① トロンビン等の試薬がコンタミしたためによるもの
② 試薬溶解方法の間違い、取り違え、試薬設置場所の間違い
延長傾向の結果となる場合には、多様な原因が考えられますので、例えば次の
点を確認し、対応を図ります。
1) 溶解手技のミス?、溶解液の取り違え?、溶解液量の間違い?
2) 溶解後の経時変化?、保存条件の不良?
3) 洗浄液・緩衝液は良好か?
4) 試薬設置場所の間違い?
5) 試薬のコンタミ?
6) 他の検体、あるいは他の項目測定結果との比較
③ 機器の場合
1) 機器内部の汚れ・故障の状況を調べる。汚れている場合にはその時点できれ
いに清掃する。(←次に動作させた時に異常が発見し易くなる)
2) データ異常が突発的であるか、継続的であるかを調べる。
3) 次に、凝固曲線においてΔHが適正であるか調べる。
4) 温度・流体系を調べる。
*試薬や緩衝液・洗浄液の設置間違いや残量不足であることが以外と多い。
5) キャリーオーバーしていないか?
C-2対応方法
原因は、検体、または、試薬、または機器のいずれかであって2つが原因となること
は、まづありません。―つの原因に絞り込み、対応するようにします。
ただ、「凝固反応そのものがおかしい?」と考えられる場合、フィブリンクロットの
形成においては下記の要因が影響を与えますので、留意しておいてください。
(1) PH
(2) 電気伝導度
(3) 浸透圧
(4) Ca
(5) 撹拌
(6) 安定化剤
(7) その他の測定条件
設問(20):異常が発生したら、凝固曲線を見るべきである、か?
Yes or No